Hoá Học 9 Bài 4 Hóa 9 : Bài 4, Giải Bài Tập Hóa 9 Bài 4: Một Số Axit Quan Trọng
Nội dung bài học giúp học sinh biết về các tính chất hóa họccủa axit HCl, H2SO4 loãng; Biết được cách viết phương trình phản ứng thể hiện tính chất chung của axit. H2SO4 đặc có những tính chất hoá học riêng: Tính oxi hoá (tác dụng với những kim loại kém hoạt động) tính háo nước, dẫn ra được những phản ứng minh họa cho những tính chất này. Những ứng dụng quan trọng của axit trong sản xuất, trong đời sống.
Đang xem: Bài 4 hóa 9
1. Tóm tắt lý thuyết
1.1.Axit clohidric
1.2.Axit sunfuric
1.3. Tổng kết
2. Bài tập minh hoạ
3. Luyện tập Bài 4 Hóa học 9
3.1. Trắc nghiệm
3.2. Bài tập SGK và Nâng cao
4. Hỏi đápvề Bài 4 chương 1 Hóa học 9
1.1.1. Tính chất hóa học (HCl có đầy đủ tính chất hóa học của axit)
Làm quỳ tím chuyển sang màu đỏ
Tác dụng với kim loại: 2Al ( r) + 6HCl (dd) → 2 AlCl3 (dd) + 3H2 (k)
Tác dụng với Bazơ: Cu(OH)2(r)+2HCl(dd) → CuCl2(dd)+ 2H2O(l)
Tác dụng với oxit bazơ: CuO (r) + 2HCl (dd) → CuCl2(dd) + H2O
Tác dụng với muối: (Học trong bài 9)
1.1.2. Ứng dụng
Điều chế các muối
Làm sạch bề mặt kim loại trước khi hàn
Tẩy gỉ kim loại trước khi tráng, sơn, mạ kim loại
Chế biến thực phẩm, dược phẩm
1.2.1. Tính chất vật líChất lỏng sánh, không màu, nặng gấp đôi nước, không bay hơi, dễ tan trong nước, toả rất nhiều nhiệtLưu ý: Khi pha H2SO4 loãng , ta cho từ từ axit vào lọ nước ( Không làm ngược lại vì nguy hiểm) 1.2.2. Tính chất hóa họcAxit H2SO4 loãng (H2SO4l)
Làm quỳ tím hoá đỏ
Tác dụng với kim loại → muối + nước.
Các em chú ý quan sát thao tác thí nghiệm và hiện tượng phản ứng diễn ra:
Video 1: Phản ứng của Mg và dung dịch H2SO4
Hiện tượng: Xuất hiện khí không màuGiải thích: Khí không màu là khí H2 sinh ra do có phản ứng Mg + H2SO4l → MgSO4 + H2.
Tác dụng với bazơ → muối + nước
Các em chú ý quan sát thao tác thí nghiệm và hiện tượng phản ứng diễn ra:
Video 2: Phản ứng giữa dung dịch Cu(OH)2 và H2SO4
Hiện tượng: Cu(OH)2 tan dần và tạo dung dịch màu xanhGiải thích: Do xảy ra phản ứng H2SO4l+Cu(OH)2 → CuSO4 + 2H2O
Tác dụng với oxit bazơ → muối + nước
Các em chú ý quan sát thao tác thí nghiệm và hiện tượng phản ứng diễn ra:
Video 3: Phản ứng giữa Fe2O3 và H2SO4
Hiện tượng: Bột Fe2O3 tan dần, tạo dung dịch màu nâuGiải thích: Do xảy ra phản ứng 3H2SO4l +Fe2O3 → Fe2(SO4)3+3H2O
Tác dụng với muối
1.2.3 Axit sunfuric đặc có những tính chất hóa học riêng
Tác dụng với kim loại
Các em chú ý quan sát thao tác thí nghiệm và hiện tượng phản ứng diễn ra:
Video 4: Thí nghiệm Đồng với axit sunfuric loãng và đặc
Hiện tượng:ống nghiệm 1: Không có hiện tượng gì (Các em thấy giống như có bọt khí thoát ra nhưng đó là do nước sôi, hơi nước bay ra thôi, dây Đồng vẫn còn giữ nguyên màu sắc)ống nghiệm 2: Có khí không màu, mùi hắc thoát ra nhiều; Đồng bị tan một phần tạo dung dịch màu xanh lam.Giải thích: H2SO4 đặc, nóng tác dụng được với Đồng, tạo khí SO2 không màu, mùi hắc; dung dịch CuSO4 màu xanh lam.Phương trình phản ứng: Cu + 2H2SO4 (đ)
.PNG)
CuSO4 + SO2 + 2H2O
Nhận xét: H2SO4 đặc tác dụng với nhiều kim loại khác → muối sunfat, không giải phóng khí H2
Tính háo nước
Các em chú ý quan sát thao tác thí nghiệm và hiện tượng phản ứng diễn ra:
Video 5: Thí nghiệm chứng minh tính háo nước của axit sunfuric đặc
Hiện tượng: Màu trắng của đường chuyển sang nâu rồi thành màu đen xếp rồi bị bọt khí đẩy trào ra khỏi miệng cốc, tỏa nhiệt nhiều.Giải thích: Chất rắn màu đen là Cacbon. Người ta nói axit sunfuric đặc có tính háo nước với phương trình C12H22O11
11H2O + 12C
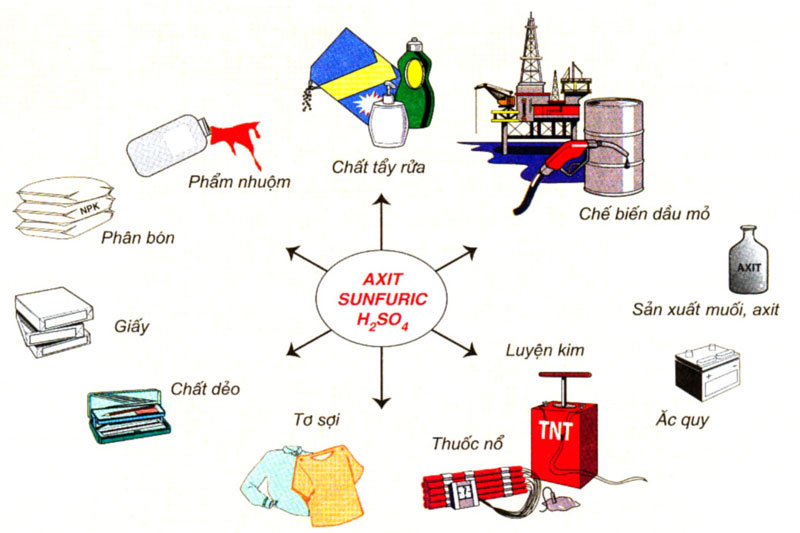
Hình 1: Ứng dụng của axit sunfuric
Trong Công nghiệp Axit sunfuric được sản xuất bằng phương pháp tiếp xúc.
Xem thêm: Rùa Tai Đỏ – Giá Bao Nhiêu Tiền
a. Nguyên liệu: Lưu huỳnh hoặc Quặng Pyritsắt (FeS2)
b. Các công đoạn chính:
Sản xuất lưu huỳnh đioxit: S + O2
.PNG)
SO2Hoặc 4FeS2 + 11O2
.PNG)
2Fe2O3 + 8SO2Sản xuất lưu huỳnh trioxit: 2SO2 + O2
2SO3Sản xuất H2SO4: SO3 + H2O → H2SO4
Video 6: Quy trình sản xuất Axit sunfuric
dd BaCl2; Ba(NO3)2 ; Ba(OH)2 được dùng làm thuốc thử để nhận ra gốc sunfatCác em chú ý quan sát thao tác thí nghiệm và hiện tượng phản ứng diễn ra:
Video 7: Thí nghiệm giữa dung dịch BaCl2 và H2SO4
Hiện tượng: Có kết tủa trắng xuất hiệnGiải thích: Gốc =SO4 trong phân tử H2SO4 kết hợp với nguyên tố Bari trong phân tử BaCl2 tạo thành kết tủa BaSO4Phương trình hóa học: H2SO4 + BaCl2 → BaSO4 + 2HCl
.PNG)
Hình 2: Tính chất hóa học của Axit sunfuric
Bài 1:
Cần phải điều chế một lượng Đồng (II) sunfat. Phương pháp nào sau đây tiết kiệm được axit sunfuric?
a, Axit sunfuric tác dụng với Đồng (II) oxit
b. Axit sunfuric đặc tác dụng với Đồng kim loại.
Viết các phương trình hóa học và giải thích
Hướng dẫn:
Phương trình hóa học a: CuO + H2SO4 → CuSO4 + H2O
Phương trình hóa học b: Cu + 2H2SO4 (đ)
.PNG)
CuSO4 + SO2 + 2H2O
Ở phản ứng a tỉ lệ phản ứng của Cu : H2SO4 là 1: 1 nên sẽ tiết kiệm được axit hơn phản ứng b theo tỉ lệ 1:2.
Hơn nữa ở phản ứng 2 tạo thêm sản phẩm SO2 là khí độc, mùi hắc là nguyên nhân chính tạo ra mưa axit gây ô nhiễm môi trường.
Bài 2:
Có 4 lọ không nhãn đựng 4 dung dịch không màu là: HCl, H2SO4, NaCl, Na2SO4. Hãy nhận biết dung dịch trong mỗi lọ bằng phương pháp hóa học. Viết các phương trình hóa học.
Xem thêm: Diễn Viên Chương Tử Di Không Đọ Được Với Củng Lợi, Chương Tử Di
Hướng dẫn:
Trích dẫn một ít dung dịch của 4 chất để làm mẫu thử rồi lần lượt tiến hành lần lượt như sau:
Dung dịch nào làm quỳ tím hóa đỏ, và không hiện tượng với dung dịch BaCl2 là dung dịch HClDung dịch nào làm quỳ tím hóa đỏ, và có kết tủa trắng với dung dịch BaCl2 là dung dịch H2SO4Dung dịch nào không làm đổi màu quỳ tím, và không hiện tượng với dung dịch BaCl2 là dung dịch NaClDung dịch nào không làm đổi màu quỳ tím, và có kết tủa trắng với dung dịch BaCl2 là dung dịch Na2SO4Bài 3:
Trung hòa 300ml dung dịch H2SO4 1,5M bằng dung dịch NaOH 40%
a. Tính khối lượng dung dịch NaOH cần dùng.
b. Nếu thay dung dịch NaOH bằng dung dịch KOH 5,6% (D = 1,045g/ml) thì lượng KOH cần dùng là bao nhiêu?














